Résumé
Traditionnellement, le terme ” épigénétique ” est appliqué aux facteurs non héritables génétiquement et impliqués dans la régulation des gènes. Si l’on a cru initialement que ces facteurs agissaient seulement sur des périodes de temps prolongés, il est maintenant clair qu’ils peuvent également être impliqués dans des processus très rapides, changeant en l’espace de quelques minutes. Les facteurs de transcription, comme les récepteurs des glucocorticoïdes, de l’estrogène et des androgènes, interagissent avec ces mécanismes épigénétiques de façon très dynamique afin de modifier la transcription des gènes contribuant ainsi aux processus physiologiques, à la santé et à la maladie. L’usage moderne du terme “épigénétique ” comprend donc non seulement les changements sur de longues périodes, mais également les changements transitoires, et cette utilisation est pertinente pour de nombreux systèmes biologiques.
Les ” switchs ” moléculaires
Même si chaque organisme n’a qu’un seul génome, ce génome est capable de coder de multiples fonctions biologiques et de générer des organismes très complexes, avec des centaines de cellules de divers types (phénotypes). Le phénotype cellulaire résulte de l’expression sélective des gènes. L’ADN est organisé en chromatine, un complexe d’ADN et de protéines histones qui forme le nucléosome (voir la figure). Cette organisation en chromatine facilite la compaction d’environ 3 m d’ADN humain pour l’inclusion dans un noyau de 6 µm de diamètre. De plus, la chromatine contrôle la transcription des gènes par le biais de mécanismes épigénétiques. Classiquement, ces mécanismes épigénétiques sont considérés comme des changements d’activité génétique héritables au cours de la mitose et/ou la méiose, et indépendants de la séquence de l’ADN. La régulation épigénétique transmet donc une mémoire d’états transcriptionnels, au travers de la modification des histones, des variantes d’histones, du remodelage de la chromatine par des complexes dépendant de l’ATP et de la méthylation de l’ADN (voir la figure). Parmi les phénotypes cellulaires transmis de cette manière, on peut compter l’empreinte parentale et l’inactivation du chromosome X. Cependant, l’usage moderne de ” l’épigénétique ” comprend aussi les altérations de la structure de la chromatine qui marquent, signalent et transmettent les états de transcription qui eux peuvent souvent être transitoires et dynamiques. Ces ” marques ” épigénétiques modifient l’accès des facteurs de transcription à l’ADN, modifiant ainsi la disponibilité des séquences des promoteurs pour l’activation ou l’inhibition par les facteurs de transcription critiques pour les activités de la cellule.
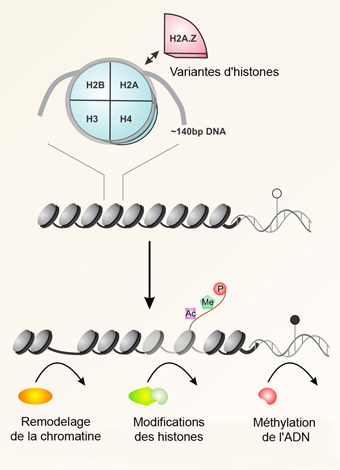 L’ADN des cellules eukaryotes forme un complexe avec des protéines histones : la chromatine. Les histones H2A, H2B H3 et H4 forment un octamère, le nucléosome. Les mécanismes épigénétiques modifient la structure de la chromatine, et parmi ces mécanismes, on peut compter des variantes des histones, comme H2A.Z, le remodelage de la chromatine, la méthylation de l’ADN et des modifications des histones, comme l’acétylation (Ac), la méthylation (Me) et la phosphorylation (P).
L’ADN des cellules eukaryotes forme un complexe avec des protéines histones : la chromatine. Les histones H2A, H2B H3 et H4 forment un octamère, le nucléosome. Les mécanismes épigénétiques modifient la structure de la chromatine, et parmi ces mécanismes, on peut compter des variantes des histones, comme H2A.Z, le remodelage de la chromatine, la méthylation de l’ADN et des modifications des histones, comme l’acétylation (Ac), la méthylation (Me) et la phosphorylation (P).
Les signatures hormonales
La régulation des gènes est assurée par les facteurs de transcription, comme les récepteurs des glucocorticoïdes, de l’estrogène et des androgènes. Ces récepteurs nucléaires forment une classe de facteurs inductibles par des stimuli qui doivent surmonter l’obstacle constitué par la chromatine condensée pour atteindre et se lier avec l’ADN. Mais, ces récepteurs provoquent des changements épigénétiques rapides et transitoires, à l’opposé de la mémoire épigénétique à plus long-terme. Grâce à cet effet rapide et direct sur la transcription des gènes en réponse au ligand hormonal, les récepteurs des stéroïdes sont des modèles idéaux pour l’étude des changements inductibles de la structure de la chromatine.
———————-
“La régulation épigénétique transmet donc une mémoire…”
———————-
Les histones peuvent être modifiées chimiquement par l’acétylation, la méthylation ou la phosphorylation (voir la figure). Une liaison à un récepteur peut modifier la méthylation et l’acétylation des histones aux résidus acides aminés spécifiques, ainsi altérant l’accessibilité de la chromatine. Les récepteurs hormonaux recrutent d’autres facteurs de régulation pour assurer ces processus. Ces cofacteurs ont une activité enzymatique qui catalyse la modification des histones. Ces signatures de modification d’histones ont donc un caractère transitoire, dépendant du recrutement des enzymes (les méthyltransferases et acétyltransferases des histones) par les récepteurs. Les complexes de remodelage de la chromatine sont également recrutés par les récepteurs. L’activité enzymatique de ces complexes modifie le contact entre l’ADN et les histones, facilitant l’accessibilité à la chromatine et la liaison avec le récepteur. L’altération de la structure de la chromatine est fortement dynamique et suit le même cours que la transcription gouvernée par les récepteurs. Ces activités ont été observées pour de nombreux gènes distribués le long du génome, y compris le gène period 1 impliqué dans les régulations circadiennes et le gène codant pour le pro-opiomélanocortine (POMC). Ces récepteurs provoquent aussi l’éviction de la variante H2A.Z de la histone 2 du nucléosome, mais les mécanismes et les effets de ce phénomène restent inconnus.
Si les récepteurs des hormones peuvent recruter des facteurs régissant les fonctions épigénétiques, les marques épigénétiques ne sont pas toutes égales. Certaines signatures épigénétiques sont établies à des étapes précoces du développement et de la différentiation et ne sont pas modifiées par l’induction de la transcription. La méthylation du résidu lysine en position 4 de l’ histone H3 est une marque épigénétique des gènes actifs et des sites fonctionnels du génome. Par contre, la méthylation du résidu lysine en position 27 de H3 est associée aux gènes silencieux. Ces marques se conforment à la définition classique de l’épigénétique, car ils persistent pendant de nombreuses divisions de la cellule. Il est important de noter que ces signatures épigénétiques sont spécifiques à la cellule, marquant les activités génétiques déterminantes pour le phénotype cellulaire.
Altération de la mémoire épigénétique
La méthylation des cytosines participe à l’empreinte parentale, la fonction synaptique neuronale, la spécificité cellulaire, l’autisme et le cancer. La méthylation d’ADN modifie la structure de la chromatine, diminuant sa capacité à se lier aux facteurs de transcription et signalant l’inactivité de la transcription. La méthylation de l’ADN est considérée, depuis longtemps, comme une mémoire épigénétique stable, héritable de génération en génération et d’une division cellulaire à une autre. Elle peut avoir un effet sur les réponses comportementales impliquant un processus de signalisation par des récepteurs, comme, par exemple, la régulation du stress par le récepteur des glucocorticoïdes. Chez les rongeurs, la privation maternelle conduit à la méthylation de l’ADN près du site de commencement de la transcription du gène codant pour le récepteur glucocorticoïde dans l’hippocampe des petits, avec des effets comportementaux. La méthylation de ce gène est également observée dans des cas humains de maltraitance de l’enfant. Ces données suggèrent que des facteurs environnementaux auxquels l’organisme est soumis tôt dans l’enfance peuvent avoir des effets épigénétiques sur la structure de la chromatine qui persistent à l’âge adulte.
Les données récentes ont modifié notre vision de la stabilité de cette mémoire épigénétique et suggèrent que ces changements sont beaucoup plus plastiques et réversibles qu’on le pensait auparavant. Des études sur l’estrogène, la vitamine D et la signalisation par le récepteur de l’hormone parathyroïdienne ont montré que la méthylation de l’ADN des gènes peut alterner cycliquement des états de méthylation et de déméthylation. Ces observations indiquent qu’une marque épigénétique ” stable ” de l’activité du gène peut aussi être modulée par des facteurs de transcription et peut réagir aux signaux environnementaux de façon dynamique.
Le long terme et le court terme
Si la définition classique de l’épigénétique est caracterisée par la mémoire à long terme de facteurs non génétiques dans la chromatine, l’usage moderne de ce terme s’étend de plus en plus à la régulation épigénétique dynamique. Les facteurs épigénétiques exercent leurs effets sur la structure de la chromatine à des niveaux différents de l’échelle temporelle, de quelques minutes pour la signalisation par des récepteurs jusqu’à des générations pour l’empreinte parentale. Le caractère dynamique de l’épigénétique a des implications pour plusieurs systèmes, comme la reprogrammation des cellules pour générer des cellules souches, la régulation des réponses au stress par des glucocorticoïdes et la régulation des cancers hormono-dépendants. L’interaction entre les récepteurs hormonaux et les facteurs épigénétiques, qui est aussi large que dynamique, souligne le potentiel du contrôle épigénétique comme cible majeur des traitements pour de nombreuses maladies, de la dépression au cancer.
Traduction :
Catherine Llorens-Cortes, INSERM U 691, Paris
Jean-Louis Nahon CNRS UMR 6097, Sophia Antipolis
Cette brève est produite par la British Society for Neuroendocrinology et peut être utilisée librement pour l’enseignement de la neuroendocrinologie et la communication vers le public.
©British Society for Neuroendocrinology et Société de Neuroendocrinologie pour la traduction.
