Résumé
L’environnement au cours de la grossesse et pendant les premières années de la vie joue un rôle essentiel pour notre développement et notre future façon de vivre. De petites perturbations de cet environnement néonatal peuvent être la cause de troubles cardiovasculaires, métaboliques et de déficits cognitifs plus tard dans notre vie. Plusieurs données montrent par exemple que le stress chronique chez la mère induit une diminution du poids du bébé et un accroissement du risque de troubles nerveux et des fonctions cognitives chez l’enfant. Les corticoides, qui semblent agir sur la programmation du développement de notre cerveau, sont ainsi élevés dans le sang en cas de stress, et peuvent donc perturber le fonctionnement cérébral.
Le gène ou l’acquis
Il est connu que les gènes hérédités de nos parents jouent un rôle essentiel dans notre façon de mener notre vie et aussi de répondre aux diverses maladies. Cependant, de nombreuses données montrent que l’environnement au cours de notre développement et de notre enfance est également impliqué. On connaît tous les effets dangereux des drogues ou de l’alcool durant la grossesse mais que sait-on des changements plus subtils au cours de cette période sur notre corps ?
Plusieurs études épidémiologiques ont montré une corrélation entre le poids à la naissance, les risques d’hypertension, l’apparition du diabète, le taux de cholestérol sanguin et les accidents cardiovasculaires. Ces observations ont emmené les chercheurs à se demander si il n’y aurait pas ” une origine fœtale aux maladies de l’adulte ” et à identifier les évènements et les facteurs qui peuvent modifier le développement fœtal et la ” programmation ” permettant d’être plus ou moins sensibles à des troubles cardiovasculaires ou métaboliques.
Evènements précoces et fonctions cérébrales
Des évènements de notre première enfance peuvent-ils programmer notre cerveau ? Le développement de nos cellules nerveuses sont extrêmement sensibles à diverses molécules comme les facteurs de croissance, les facteurs de transcription génique et les hormones, telles les hormones stéroides, qui peuvent altérer le renouvellement des cellules, leur migration et la formation des réseaux nerveux. Des modèles animaux ont été utilisés pour démontrer ces phénomènes, en particulier les conséquences d’une manipulation de l’environnement prénatal, comme le stress prénatal, au cours duquel la mère gestante est soumise à un agent stressant non prévu comme la lumière intense ou le bruit. Les candidats potentiels ont été naturellement les corticoides libérés par la glande surrénale au cours de ces épisodes de stress.
Bien qu’il y ait une barrière empêchant les corticoides de franchir le placenta (ce dernier fabriquant une enzyme qui détruit ces hormones), celle-ci peut être rompue, rendant le fœtus directement exposé à ces stéroides. Ainsi l’administration à haute dose d’un corticoide synthétique ou d’un inhibiteur de cette enzyme produit les mêmes effets que le stress prénatal avec une diminution du poids, une hypertension et un taux de glucose élevé dans le sang. Les forts taux de corticoides aboutissent après un certain temps à une hyperactivité de l’axe corticotrope ou axe du stress qui se traduit par une augmentation de l’expression dans le cerveau du gène d’un peptide, le CRH (corticotrophin-releasing hormone), qui a son tour accroît la libération de corticoides.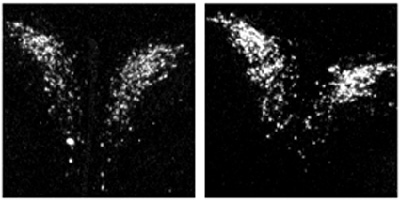
Figure 1 : Photographies montrant l’expression du gène du CRH dans le noyau paraventriculaire de l’hypothalamus chez le rat adulte dont la mère a été traitée (à droite) ou non (à guche) par un corticoide de synthèse, la dexaméthasone. L’expression du CRH est ainsi augmentée chez les animaux dont la mère a été traitée entre 14-20 jours de grossesse par le stéroide. Cette augmentation provoque une activation de l’axe du stress et une production encore accrue de corticoides dans le sang.
Des tests spécifiques ont montré que les petits dont la mère a reçu ces fortes doses de corticoides sont plus anxieux. Leur habilité cognitive est également affectée. Les petits ont ainsi plus de mal à apprendre dans les tests de mémoire spatiale. Ces changements comportementaux sont liés à des modifications neurochimiques dans une région cérébrale, l’amygdale, qui joue un rôle clé dans les phénomènes de peur et d’anxiété.
A-t-on les mêmes risques chez l’homme ?
De façon frappante, un faible poids de naissance a pu être considéré comme un facteur de risque d’autisme, de dépression et de suicide. Un stress de la mère (par exemple un décès dans la famille) durant la grossesse peut être associé à une diminution du temps de la grossesse et à une diminution de la croissance fœtale aboutissant à des troubles comportementaux chez l’enfant. En outre, un stress postnatal cette fois, peut induire des effets identiques avec des troubles du comportement et de la personnalité plus tard à l’âge adulte. Ces observations suggèrent que la période de ” programmation ” n’a pas lieu seulement durant la vie fœtale, mais s’étend aussi à la période postnatale. Il reste qu’il est parfois difficile de dissocier des effets chez le fœtus et chez le nourrisson, les mêmes circonstances environnementales étant souvent présentes.
Peut-on faire quelque chose ?
Il est cependant possible dans certains cas de déterminer la part revenant à la période fœtale de celle du nouveau-né. Des études chez l’animal en utilisant un test de manipulation des petits rats (handling) qui stimule le contact avec la mère, produit de tels effets bénéfiques sur l’axe du stress et le comportement, qu ‘il est même possible de contrecarrer les effets négatifs d’un stress prénatal. Il serait souhaitable que les médecins soient conscients des conséquences à long terme de ces faits intervenant au cours de la période périnatale et qu’ils puissent agir pour réduire ces effets ; par exemple, réduire le stress pendant la grossesse et éviter les trauma psychologiques, éviter si possible l’utilisation de corticoides chez la femme enceinte ou le nourrisson.
Ces données issues de la neuroendocrinologie nous permettent d’appréhender sous un jour nouveau les facteurs de risque précoces et préparer une prévention adéquate pour les personnes à risque.
Document à télécharger : PDF
Traduction : William Rostène, INSERM U732, Paris
Cette brève est produite par la British Society for Neuroendocrinology et peut être utilisée librement pour l’enseignement de la neuroendocrinologie et la communication vers le public.
©British Society for Neuroendocrinology et Société de Neuroendocrinologie pour la traduction.
