Résumé
On ne peut nier que l’obésité se développe lorsqu’on consomme plus d’énergie que l’on en dépense. Mais pourquoi certaines personnes mangent-elles plus que d’autres ? Des analyses génétiques récentes révèlent que des variants dans le gène FTO (pour fat mass and obesity-associated, associé à l’obésité et à la masse grasse) sont fortement associés à une obésité et une prise alimentaire importante. Cette association a été retrouvée dans plusieurs populations d’âges différents et la biologie complexe de FTO est maintenant à l’étude.
Un problème d’actualité
L’obésité est un des grands défis de santé publique du 21eme siècle. Sa prévalence a triplé dans de nombreux pays dans les trente dernières années et continue à augmenter à un rythme alarmant. Dans l’union Européenne, près de 150 millions d’adultes et 15 millions d’enfants sont considérés comme obèses. Le problème n’est pas tant l’obésité en elle-même que les risques accrus qu’elle entraine pour une série de maladies graves et souvent mortelles comme le diabète de type 2, les maladies cardiovasculaires, l’hypertension et certains cancers.Donc, comment expliquer cette augmentation rapide du poids corporel de la population générale ? Nos gènes ont-ils changés ? Avons nous soudain évolué ? Evidemment non. Ces changements dramatiques ont eu lieu sur quelques dizaines d’années, avec un pool de gènes constants et pendant une partie de la vie de la plupart des lecteurs de cette brève. Le coupable est donc un « changement environnemental », une formule suffisament vague pour décrire un changement de style de vie, de conditions de travail et sans doute surtout de régime alimentaire. Qu’on le veuille ou non, la seule façon de gagner du poids et de manger plus que ce que l’on brule.
Cependant, il est aussi clair que les individus répondent différemment à ces changements environnementaux. Certains développent une surcharge pondérale, une obésité plus ou moins grave alors que d’autres ne gagnent pas un gramme !
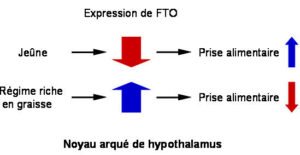
Le jeûne diminue l’expression de FTO de manière spécifique dans le noyau arqué de l’hypothalamus alors qu’un régime riche en graisse l’augmente. En accord avec ceci, réduire l’expression de FTO augmente la prise alimentaire et surexprimer le gène la diminue.
Un milliard d’individus pesant 3 kg de plus.
Dans les quinze dernières années, les études des syndromes monogéniques d’obésité à hérédité mendélienne, chez l’homme comme chez la souris, ont mis en lumière les réseaux neuronaux qui contrôlent la prise alimentaire et la masse corporelle. Chez l’homme, cependant, ces causes monogéniques d’obésité sévère sont extrêmement rares. L’obésité commune est due à l’interaction de nombreux gènes (étiologie polygénique), chacun des variants entrainant des effets subtils.Ce n’est que très récemment qu’une technologie adéquate pour déterminer en parallèle un million de variants génétiques a été développée. En 2007, une telle étude de tour du génome (genome-wide association study) identifia de nombreux polymorphismes sur un gène qui fut alors nommé lié à l’obésité et la masse grasse (en anglais fat mass and obesity related, FTO). Ces polymorphismes étaient associés à un indice de masse corporelle élevé : les individus homozygotes pour l’allèle « à risque » pesant en moyenne 3 kg de plus que ceux portant l’allèle « protecteur ». Des études ultérieures indiquèrent que les allèles à risque étaient également associés à une prise alimentaire plus importante.Si l’effet des allèles à risque du gène FTO semble modeste, ces allèles sont très communs, avec un milliard de sujets homozygotes dans le monde à travers les origines ethniques et les populations. Pourtant, la fonction biologique de FTO reste inconnue.
La complexité de la biologie de FTO
FTO appartient à une famille d’enzymes, les dioxygénases, qui sont impliquées dans de nombreux processus cellulaires, en particulier la réparation des acides nucléiques. In vitro, FTO peut retirer les lésions des groupements méthyl sur les simples brins d’ADN ou d’ARN. Cependant, nous ne savons pas comment cette action de déméthylation est liée à l’obésité.
———————
“…La seule façon de gagner du poids est de manger plus que ce qu’on brûle en calories…”
——————–
En 2009, une mutation inactivatrice de FTO, la substitution d’un acide aminé en position 316 de la protéine (R316Q), fut découverte chez 9 arabes palestiniens apparentés et souffrant de retard de croissance, de retard mentaux et de malformations cardiaques sévères. De manière tragique, la sévérité du phénotype était telle que tous les enfants atteints moururent avant l’âge de 30 mois.
Les souris invalidées pour le gène FTO développent un phénotype complexe. Comme les sujets humains décrits au paragraphe précédent, elles présentent un retard de croissance avec une diminution de la masse grasse et de la masse maigre et 50% meurent avant le sevrage. Ainsi, FTO semble jouer un rôle critique, bien qu’encore mystérieux, dans le développement de nombreux organes et systèmes, cerveau et cardiovasculaires, en particulier.
L’obésité, c’est tout dans la tête.
FTO est exprimé dans de nombreux tissus mais l’expression la plus élevée est retrouvée dans une région profonde du cerveau : l’hypothalamus. De manière intéressante, si le gène n’est invalidé que dans les neurones, les souris développent le même phénotype que lorsqu’il l’est dans le corps entier. Ce résultat suggère fortement qu’une grande partie des fonctions de FTO, régulation de la balance énergétique comprise, dépend du cerveau. Dans le noyau arqué de l’hypothalamus, les niveaux de FTO sont réduits par le jeûne et augmentés quand les animaux sont nourris avec un régime riche en graisse. Contrairement au phénotype sévère des souris déficientes en FTO, la perturbation légère des niveaux de FTO dans le noyau arqué influence la prise alimentaire : un niveau réduit d’expression de FTO entrainant une augmentation et vice versa (figure 1).Ainsi, si FTO intervient probablement dans de nombreuses fonctions biologiques, il a également un rôle spécifique au sein de l’hypothalamus pour réguler la prise alimentaire.
Traduction :
Jacques Epelbaum, Centre de Psychiatrie & Neuroscience, UMR 894 Inserm-Université Paris Descartes, Paris France
Cette brève est produite par la British Society for Neuroendocrinology et peut être utilisée librement pour l’enseignement de la neuroendocrinologie et la communication vers le public.
©British Society for Neuroendocrinology et Société de Neuroendocrinologie pour la traduction
